Die Wissenschaft ist überall um uns herum, und in diesem Fall ist die Chemie überall dort, wo wir suchen. Wir alle haben ein Periodensystem gesehen, das die Organisation der Elemente beschreibt, aber es zeigt uns nicht, wie man sie verwendet. So, hier sind 13 der häufigsten Anwendungen für einige der Elemente des Periodensystems.
Wasserstoff
Dies ist das leichteste Element des Tisches, und es ist auch ein explosives Gas. Es wird als Brennstoff verwendet. Tatsächlich hat die NASA dieses Gas als Haupttreibstoff in ihrem Space Shuttle-Programm verwendet.
Helium
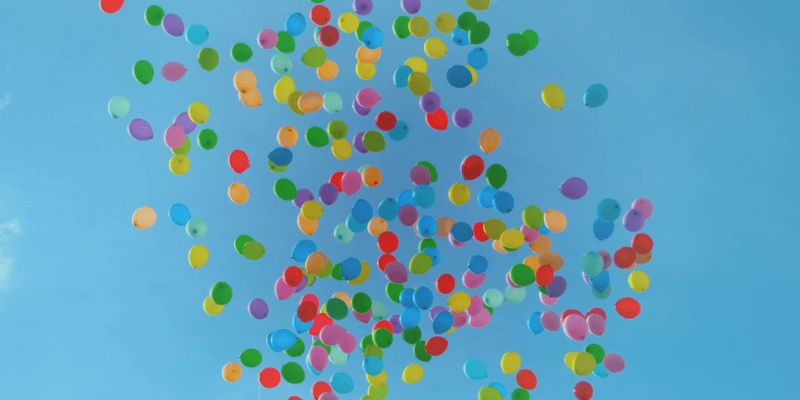
Ja, das ist das Gas, das Ihre Stimme lustig klingen lässt. Helium wird zum Auffüllen von Ballons verwendet, wodurch sie schweben, da dieses Gas eigentlich leichter ist als Luft.
Lithium

Genau wie das Nirvana-Lied. Dieses ist ein Metall, das die Hersteller verwenden, um Kochgeschirr widerstandsfähiger zu machen. Wir verwenden es auch zum Bau von Batterien und als Mittel zur Behandlung von bipolaren Störungen.
Kohlenstoff
Dieses Element ist praktisch überall zu finden. Von organischen Brennstoffen (Gas, Kohle und Öl) bis hin zum Graphit finden wir auf Bleistiften, Tiegeln und Elektroden. Sie sind auch bekannt für ihre Fähigkeit, sich in Diamanten verwandeln zu lassen.
Stickstoff
Dieses Gas macht etwa 78% der Erdatmosphäre aus, kann aber auch in Düngemitteln, Nylon und Sprengstoffen eingesetzt werden. Wir können es auch zusammen mit Wasserstoff zur Herstellung von Ammoniak verwenden.
Sauerstoff
Es ist das wichtigste Gas für die Menschheit, denn ohne es wären wir nicht überlebensfähig. In der Medizin wird Sauerstoff zur Behandlung von Atembeschwerden verwendet, und die NASA nutzt ihn, um ihre Raumschiffe lebenswert zu machen. Auch die Großindustrie nutzt dieses Gas zur Herstellung von Stahl und anderen Metallen.
Fluor

Es ist das reaktionsfähigste Element. Wir verwenden dieses Gas in Zahnpasta und Trinkwasser. Es kann auch Glas auflösen.
Neon
Es ist auch ein Gas, und wir benutzen es, um Zeichen zu setzen, weil es so reagiert, wenn wir es mit Strom mischen, der es zum Leuchten bringt. Die Hersteller verwenden es auch in Lasern und Hochspannungsanzeigern.
Natrium
Aus diesem Weichmetall stellen wir Speisesalz, Natron und Borax her. Straßenlaternen brauchen auch Natrium, weil sie ihr gelbes Licht produzieren.
Magnesium

Dieses Metall ist für das menschliche, pflanzliche und tierische Leben unerlässlich. In der Medizin wird sie auch als Milch aus Magnesia, Chlorid und Citrat verwendet.
Aluminium

Wir können dieses Element an vielen Stellen finden, da wir es für die Herstellung von Dosen, Auto- und Flugzeugteilen und vielen anderen Dingen verwenden. Unternehmen verwenden es so oft, weil es sich um ein nicht korrodierendes Metall handelt.
Phosphor

Dieser hier ist ein solider und wirklich wichtiger Bestandteil des organischen Lebens. Wir verwenden es in Düngemitteln, um den Phosphorkreislauf der Pflanzen zu unterstützen, und wir verwenden es auch in Sprengstoffen und Feuerwerken.
Chlor

Es ist ein grünliches Gas, das in der Antiseptik und Wasserbehandlung verwendet wird. Wir verwenden Chlor auch zur Herstellung von Papier, Kunststoff, Lösungsmitteln und Textilien. So ist es gut! Dies sind nicht einmal die Hälfte der Elemente des Periodensystems, aber sie gehören zu den am häufigsten vom Menschen verwendeten.
